Рак крови
 Лечащие врачи: Гематолог, Онколог
Лечащие врачи: Гематолог, ОнкологОбщие сведения
Рак крови называется лейкозом (Википедия). Это не совсем верное определение, поскольку термин «рак» относятся лишь к новообразованиям из эпителия, однако в обиходе равноценно используются понятия «раковый»/«онкологический» под которыми зачастую подразумеваются все остальные злокачественные опухоли. Лейкозы представлены обширной группой гетерогенных заболеваний системы крови опухолевого генеза, возникающие вследствие мутаций в генах, которые протекают с нарушениями процессов пролиферации, дифференцировки и созревания кроветворных клеток. Такие процессы приводят к «вытеснению» физиологически нормальных кроветворных клеток лейкозными, образованию очагов экстрамедуллярного кроветворения/бластных инфильтратов, негативно воздействующие на структуры/функции организма опухоленосителя.
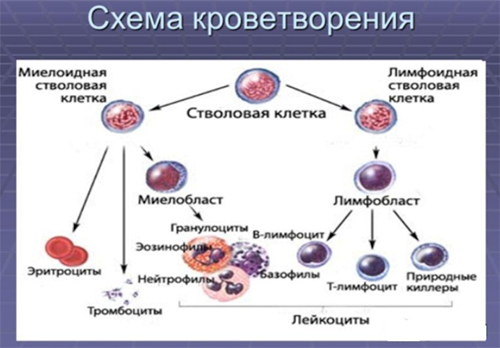
При нормальном костномозговом кроветворении стволовые клетки (бласты, клетки-предшественницы) проходя этапы дифференцировки, созревания в зрелые клетки и размножения, формируют два ростка крови:
- лимфоидный (В-/Т-лимфоциты);
- миелоидный (нейтрофилы — эритроциты, гранулоциты, тромбоциты).
При нарушении созревания бластов в зрелые клетки в костном мозге постепенно накапливаются бласты, при этом, в периферической крови уменьшается количество физиологически нормальных клеток крови и появляются бластные клетки, которые могут формировать внекостномозговые очаги поражения (лимфоузлы, селезенка) при выходе за пределы костного мозга. Лейкозные клетки не тождественны элементам нормального гемопоэза (бластным, созревающим и зрелым клеткам). Для них характерны гистохимические, иммунофенотипические, цитоморфологические и генетические аномалии.
По происхождению (гистогенезу) выделяют формы острого и хронического лейкоза. Следует отметить, что к этим понятиям традиционный подход применять нельзя: острый лейкоз никогда в хронический не переходит, а хронический лейкоз острым стать не может, поскольку при остром лейкозе поражается стволовые (незрелые) клетки крови, а при хроническом — различные созревающие/зрелые клетки крови.
Выделяют две принципиально различающиеся большие группы острых лейкозов:
- острые лимфобластные лейкозы (ОЛЛ);
- острые миелоидные лейкозы (ОМЛ).
Каждая группа делится на множество подвидов, имеющие свои характерные генетические, морфологические, иммунологическими свойства и специфику лечения.
Заболеваемость острыми лейкозами в разных странах варьирует в пределах 2-5 случаев/100 000 населения/в год. При этом, 75-80% всех острых лейкозов у взрослых приходится на ОМЛ и лишь 20-25% на долю ОЛЛ. Средний возраст постановки диагноза ОМЛ — 63 года. При этом, гендерные отличия у лиц молодого/среднего возраста не выявлены, а у старшей возрастной группы преобладают лица мужского пола (3:2).
Максимум заболеваемости ОЛЛ приходится на детский возраст 2-5 лет (средний возраст постановки диагноза 14 лет). Относится к наиболее частым онкозаболеваниям детского возраста. В целом 60% заболевших составляют лица моложе 14 лет, и лишь 24% — старше 45 лет. Гендерные различия отсутствуют.
Острые лейкозы относятся к потенциально излечимым заболеваниям. При ранней диагностике и современной терапии конкретного варианта лейкоза у 65-75% пациентов с ОМЛ и у 75-90% пациентов с ОЛЛ удается добиться полной ремиссии в периоде 5 лет.
В связи с ограниченностью объема статьи рассмотрим лишь острые миелоидные лейкозы у взрослых и острые лимфобластные лейкозы у детей, как наиболее часто встречаемые.
Патогенез
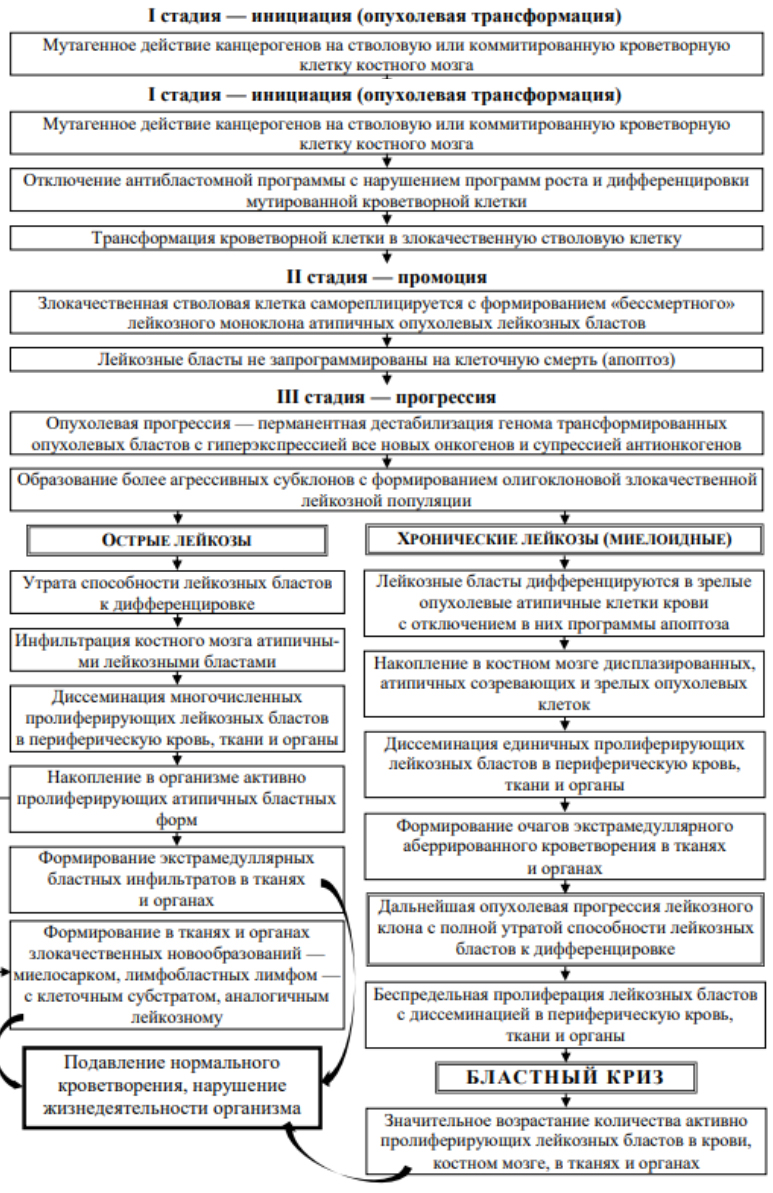
В основе лейкозогенеза лежат молекулярногенетические механизмы. Для патогенеза лейкозов характерны стадийные молекулярно-генетические нарушения, отражающие типичную фазность процесса развития злокачественных новообразований. Выделяют несколько стадий патогенеза:
- Стадия инициации (опухолевая трансформация), развивается в стволовой/коммитированной гемопоэтической клетке костного мозга под влиянием различных канцерогенов. В ее основе точковые делеции (мутации) генов-супрессоров (антионкогенов)/онкогенов с подавлением антибластомной программы, гиперэкспрессия онкогенов. В результате таких генных мутаций мутированная стволовая клетка приобретает способность к беспредельному делению, т. е. опухолевому росту, а гемопоэтическая стволовая клетка теперь становится стволовой лейкозной клеткой.
- Стадия промоции (соответствует моноклоновой стадии лейкоза). В случаях наличия в организме человека промоторных факторов, которые усиливают клеточную пролиферацию, стволовая лейкозная клетка начинает беспредельно делиться, что является основой образования бессмертного моноклона лейкозных клеток с наращиванием в последствии его численности. То есть, в основе формирования опухолевой популяции в костном мозге лежит возникновение вначале одной злокачественной стволовой клетки и затем — образования клона.
- Стадия прогрессии (соответствует олиго-поликлоновой стадии лейкоза). На этой стадии дальнейшие множественные мутации способствуют более выраженной дестабилизации генома измененных клеток моноклона с гиперэкспрессией новых онкогенов на фоне супрессии антионкогенов. Как следствие, возникновение агрессивных злокачественных субклонов с постепенным замещением физиологически нормального гемопоэза, диссеминацией (распространением) опухоленосителя гематогенным путем в различные ткани организма с формированием инфильтратов пролиферирующих бластов, а также очагов извращенного гемопоэза. Таким образом, популяция лейкозных клеток становится олиго-/поликлоновой, оказывающей агрессивное действие, что выражается прогрессирующим клиническим утяжелением течения острых лейкозов или же бластными кризами при хронических лейкозах. Схематически патогенез лейкозов приведен на рисунке ниже.
Классификация
В основе классификации лейкозов лежат различные признаки, согласно которым выделяется несколько видов.
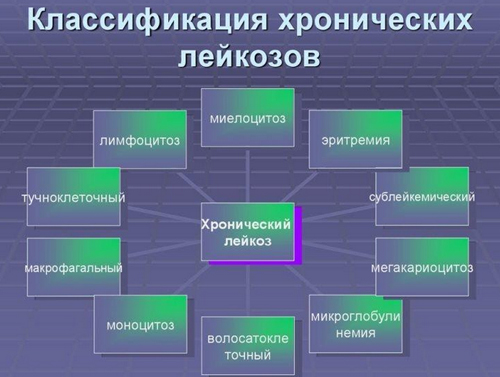
По течению (по способностью клеток крови к дифференцировке и опухолевой прогрессии) острые и хронические.
По гистогенезу (ростку гемопоэза):
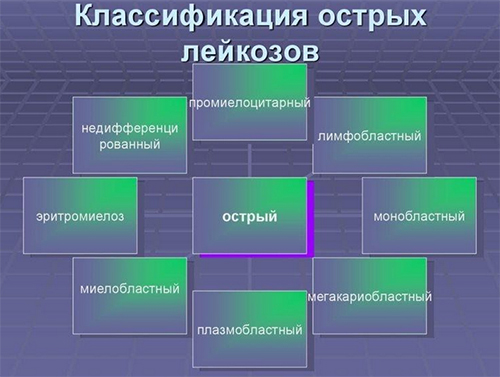
- Острые лейкозы — недифференцированный, лимфобластный (из В-клеток/Т-клеток предшественников) миелобластный, монобластный, миеломонобластный, мегакариобластный, промиелоцитарный, эритромиелобластный.
- Хронические лейкозы — хронический лимфолейкоз, хронический миелоидный лейкоз, парапротеинемические лейкозы и др.
По общему количеству лейкоцитов — лейкопенические (<4000/мкл); алейкемические (4000–20000/мкл); сублейкемические (20000–50000/мкл) и лейкемические (>50000/мкл).
Причины
Лейкозы являются полиэтиологичными заболеваниями. Установлено, что причиной рака крови являются мутации, являющиеся доказанным предиктором развития заболевания. От чего бывают мутации? Точные причины, запускающие процесс мутации неизвестны, но достоверно установлено, что существуют факторы риска, воздействие которых на организм человека повышает вероятность развития онкозаболеваний. Факторами такого рода являются: воздействие на организм физических/химических, биологических канцерогенов. Особо важное значение принадлежит воздействию химических канцерогенных веществ (толуол, бензол, мышьяк и др.), ионизирующей радиации, цитостатическим лекарственным препаратам, бытовым факторам (курение, пищевые добавки, выхлопы автомобилей), некоторым РНК- и ДНК-онковирусам. Чаще онкозаболевания развиваются на фоне наследственных/приобретенных дефектов иммунной системы.
Большое значение в развитии лейкозов имеет генетическая предрасположенность: наличие родственников больных острым лейкозом резко повышает риск заболевания. Как передается предрасположенность к онкозаболеваниям? В основе этого процесса лежат генетические патологии/хромосомные аномалии. Так риск заболеть острым лейкозом повышается при болезни Дауна, анемии Фанкони, синдроме Луи-Барра, Вискотта-Олдрича, Клайнфельтера и др.
Симптомы
Острый миелоидный лейкоз у взрослых проявляется преимущественно формированием анемического, геморрагического, инфекционного синдромов, что обусловлено метаплазией нормальной гемопоэтической ткани костного мозга лейкозными бластами, приводящей к выраженной костномозговой недостаточности. Какие-либо специфические симптомы на ранних стадиях ОМЛ отсутствуют. Может иметь место слабость, снижение аппетита, утомляемость, повышение температуры без катарального воспаления, незначительная потеря массы тела. В периоде разгара заболевания симптомы рака крови проявляются:
- Выраженным анемическим синдромомом, который обусловлен подавлением лейкозными бластами эритропоэза и представлен тяжелой метапластической анемией, проявляющейся головокружениями, бледностью кожных покровов, обморочными состояниями.
- Геморрагическим синдромом, в основе которого нарушения со стороны, свертывающей/противосвертывающей систем крови, мегакариопоэза (тромбоцитопения), что выражается петехиальными кровоизлияниями, повышенной кровоточивостью, при ушибах образованием гематом.
- Инфекционным синдромом, который вызван развитием миелотоксического агранулоцитоза, панцитопении, провоцирующих развитие тяжело притекающих вирусных/бактериальных поражений организма (преимущественно герпетических).
- Интоксикационный синдром проявляется анорексией, слабостью, лихорадкой, снижением массы тела вплоть до кахексии, нарастающих при наличии резистентности к цитостатической химиотерапии.
- Гиперпластический синдром характеризуется развитием регионарной/генерализованной лимфаденопатией сплено/гепатомегалией, образованием кожных лейкемидов, гиперплазией десен, что обусловлено образованием/формированием в органах и тканях экстрамедуллярных инфильтратов размножающихся бластов.
- Нейролейкемический синдром. Вызван метастазированием бластов непосредственно в оболочки головного/спинного мозга, что проявляется нарушением мозгового кровообращения и появлением менингеальных симптомов (головная боль, симптом Кернига, ригидность затылочных мышц, парез глазодвигательного/лицевого нервов, парезы нижних конечностей), развитием очаговых поражений ЦНС (расстройства сенсорной/локомоторной функций), бластной инфильтрацией как черепно-мозговых, так и периферических нервов с постепенным формированием болевого синдрома. Бластные пролифераты в суставах/костях вызывают интенсивные боли.
В период ремиссии ОМЛ признаки рака крови минимальны или полностью исчезают. Симптоматика рецидивов аналогична периоду разгара. В терминальном периоде состояние больного прогрессирующе ухудшается и завершается летальным исходом.
Анализы и диагностика
Установление диагноза осуществляется на основании жалоб пациента, его физикального обследования и данных лабораторных анализов. С этой целью проводятся:
- Общий анализ крови. Общий анализ крови при раке является базовым исследованием. По анализу крови определить рак можно с большой долей вероятности. При острых лейкозах в периферической крови содержание бластных клеток может достигать 90–95% всех лейкоцитов. Характерны анемия, панцитопения/тромбоцитопения и специфический признак — лейкемический провал (присутствие в периферическом кровотоке лишь бластных клеточных элементов, при полном отсутствии переходных форм). Для диагноза ОМЛ необходимо наличие в мазке периферической крови 20% или более бластных клеток.
- Биохимический анализ крови. Снижены показатели альбумина, фибриногена, глюкозы и повышены показатели билирубина, мочевины, гамма-глобулинов, ЛДГ.
- Иммунологический анализ на базе моноклональных антител. Этот анализ крови на рак называется зачастую как анализ на онкомаркеры. Заключается в обработке флюоресцентными моноклональными антителами форменных элементов крови и внедрении в кровеносный сосуд с последующей оценкой.
- Цитологическое исследование пунктата костного мозга и оценка миелограммы, позволяющая получить точное представление о характере эритропоэза.
Дополнительно проводятся инструментальные исследования (ЭКГ, КТ головного мозга/органов грудной клетки, УЗИ органов брюшной полости/ внутрибрюшных и периферических лимфоузлов и др.).
Лечение рака крови
Целью является устранение клона, восстановление кроветворения и достижение безрецидивной выживаемости. Можно ли вылечить лейкоз? Это зависит от множества факторов, но основным является цитогенетическая и молекулярная характеристика лейкоза и на основании этого правильно сделанный выбор схемы лечения. В зависимости от цитогенетической и молекулярной характеристики лейкозы бывают с благоприятным, промежуточным и неблагоприятным прогнозом. Максимальная эффективность наблюдается в том случае, если лечить заболевание в зависимости от варианта, строго по разработанным схемам и соблюдая принципы химиотерапии:
- использование адекватных доз цитостатиков;
- использование комбинации препаратов (3-7) для получения большего эффекта и уменьшения риска лекарственной резистентности;
- соблюдение этапности в лечении.
Лечится лейкоз в несколько этапов: индукция ремиссии, консолидация и поддержание ремиссии. Эффективность химиотерапии зависит от специфичности цитостатического препарата и сопроводительного лечения.
Индукция ремиссии достигается полихимиотерапией. Уничтожается основная масса лейкозных клеток. Стандартно при миелолейкозе назначаются даунорубицин или идарубицин, цитарабин и кладрибин. Первый курс индукции проводится по схеме «7+3» — 7 дней вводится цитарабин и 3 дня даунорубицин или идарубицин. Потом или повторяют курс аналогичный первому, или усиливают интенсивность воздействия (высокодозный курс).
Регенерация костного мозга наступает месяц от начала лечения. Критериями полной ремиссии являются наличие бластов в костном мозге менее 5%, отсутствие бластов в крови и экстрамедуллярных изменений. Индукционная терапия одинакова для разных подтипов миелолейкоза, но модифицируется в зависимости от возраста и сопутствующих заболеваний больного. После индукционной терапии ответ на лечение оценивается на 21-27-й день. Если полная ремиссия после проведения двух курсов индукции не достигается, то это устанавливается первичная резистентность, что является плохим долгосрочным прогнозом заболевания. Такие больные после первого курса должны рассматриваться как потенциальные кандидаты на трансплантацию аллогенного костного мозга.
Консолидирующее лечение назначается после достижения ремиссии. Ее цель — устранение лейкемических клеток, которые сохранились, но их нельзя обнаружить обычными исследованиями, а только при помощи проточной цитометрии. Консолидация при миелолейкозе может быть в двух вариантах: химиотерапия и химиотерапия + трансплантация стволовых клеток. В первом случае применяются высокие дозы цитарабина, но в зависимости от группы риска подходы разные:
- проводят 2-4 цикла в группе благоприятного риска;
- в группе неблагоприятного и промежуточного риска лечение проводится до получения лучшей полной ремиссии.
При благоприятном прогнозе — ауто-ТГСК проводят после 2-х циклов консолидации. При неблагоприятном и промежуточном прогнозе возможны варианты:
- аллогенная ТГСК (от совместимого родственного или неродственного донора);
- ауто-ТГСК, если нет донора или есть противопоказания к алло-ТГСК.
Больным с рецидивом после алло- ТГСК может быть рекомендована вторая алло-ТГСК. Поддерживающая терапия при остром миелолейкозе в некоторых клиниках молодым пациентам не назначается, поскольку это не влияет на общую выживаемость. Если же она проводится, то назначаются препараты Цитарабин и Циклофосфамид или Цитарабин +6-меркаптопурин.
Сопроводительное лечение имеет большое значение для повышения эффективности и для выживаемости пациентов. Оно включает:
- Профилактика инфекции. Больного изолируют в отдельной палате или боксе, назначаются фторхинолоны для профилактики бактериальной инфекции, противогрибковые и противовирусные препараты.
- Профилактика синдрома лизиса опухоли. При лейкозах применяется лейкаферез, а также увеличивается объем жидкости до 3-4 л.
- Борьба с гиперлейкоцитозом предусматривает немедленное начало индукционной терапии или применение гидроксимочевины.
- Устранение анемии и тромбоцитопении. По показаниям переливается эритроцитарная масса и тромбоконцентрат.
- Рациональное питание (возможно энтеральное или парентеральное).
- Лечение тошноты и рвоты.
Излечим или нет лейкоз? В последние годы разработано патогенетическое лечение некоторых видов — излечим хронический миелоидный лейкоз и острый промиелоцитарный. Выздоровевшим считают больного, у которого отмечается клинико-гематологическая ремиссия после полного курса терапии на протяжении 5 лет. У 60-70% с острым миелолейкозом после полной ремиссии в ближайшие 3 года развивается рецидив.
Терапевтических подходов к лечению рецидива мало и прогноз после рецидива неблагоприятен. Выживаемость зависит от возможности достичь повторную ремиссию и провести трансплантацию костного мозга. Больные с ранним рецидивом (ремиссия меньше полгода), цитогенетическими аномалиями имеют плохой прогноз.
Часто встречается вопрос, помогает ли чистотел при лейкозе? Нами рассмотрены схемы лечения, в которых серьезные препараты применяются длительно, чередуются и не всегда достигается результат, поэтому применять чистотел для лечения данного заболевания нецелесообразно.
 Бюджетное учреждение
Бюджетное учреждение